
Hibridização do carbono: entenda tudo!
Quem terminou o ensino médio e vai prestar Enem, deve saber a importância de fazer uma boa prova de Ciências da Natureza para garantir uma vaga na Universidade. Se esse é o seu caso, não perca o texto de hoje: entenda tudo de hibridização do carbono.
Caso você goste de estudar Química e não vê problemas ao lidar com a tabela periódica, vai adorar o conteúdo que preparamos. É sempre bom aprender essa matéria tão fascinante, ainda mais se deseja cursar Medicina ou outro curso da área da saúde.
O carbono é um dos elementos mais cobrados nas provas de vestibular, e agora você vai aprender o processo de hibridização de seus átomos (sp3, sp2 e sp) para gerar novas orbitais.
Ficou ansioso para aprender essa matéria? Ela não é um “bicho de sete cabeças”, podemos garantir. Não deixe para estudar depois, confira agora o conteúdo completo!
O que é hibridização do carbono?
Basicamente, esse processo é o desenvolvimento de formação das orbitais eletrônicas mistas. Alguns átomos têm a capacidade de entrelaçar os subníveis de suas órbitas “s” e “p”, originando a hibridização do carbono sp sp2 sp3.
Ou seja, esse fenômeno faz com que as partículas atômicas realizem um número mais elevado de ligações, desenvolvendo estabilidade. Ele consiste na mistura dos campos atômicos incompletos, que sofrem mutação, dando origem a novas estruturas de número equivalente. O resultado desse processo são os denominados orbitais híbridos.
De acordo com a teoria das ligações covalentes, uma conexão desse tipo acontece pela superposição de campos semi-preenchidas (de apenas um elétron). Algumas conexões atômicas que seriam impossíveis de serem realizadas são explicadas pela teoria da hibridização, bem como a distribuição geométrica de uma porção de moléculas.
Ligações das moléculas carbono
Chegou a hora de aprender sobre as ligações importantes para as transformações dos carbonos hibridizados. Continue a leitura para compreender melhor o assunto.
Ligação pi ( )
)
Essa conexão acontece quando os eixos atômicos se interpenetram em órbitas paralelas e formam ligações duplas ou triplas. Somente o orbital “p” apresenta condições para realizar esse processo, sendo ele mais fraco que a ligação sigma (σ).
Ligação sigma (σ)
Nessa conexão, a interpenetração de orbitais atômicos acontecem no mesmo eixo. Por esse motivo, ela é chamada de ligação simples.
Você deve compreender que, o híbrido sp2 surge apenas na ligação sigma (σ), enquanto o híbrido sp3 possui uma ligação sigma (σ) e o resto em pi (
Hibridização do carbono sp2
Para uma melhor compreensão, saiba que esse tipo de conexão do carbono acontece no momento em que um dos orbitais “p” não se mistura. Isso acontece em moléculas de eteno, por exemplo, onde existe uma dupla ligação entre as moléculas carbonáticas.
Podemos elucidar a fórmula da estrutura dessa maneira:
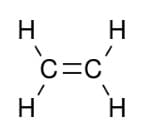
Não é verdade a afirmação que todos orbitais sofrem hibridação, pois eixos híbridos são formados apenas por ligações sigma (σ). Mesmo com as conexões duplas formando ligações pi (
A distribuição eletrônica é exemplificada pela fórmula abaixo:
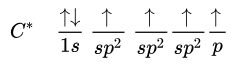
Durante esse processo, um elétron do eixo “s” passa para o orbital “p” vazio que origina o carbono intermediário (estado avançado). Porém, a junção das orbitais acontece somente entre o eixo “s” e dois “p”, formando dessa maneira o carbono hibridizado.
Hibridização do carbono sp3
Compreenda que híbridos do tipo sp3 se formam a partir de uma molécula carbonática que efetue quatro ligações sigma (σ) resultando na junção de eixos atômicos puros.
De acordo com o modelo de orbitais desenvolvido por Linus Pauling, na década de 1960, uma ligação covalente que produz novas partículas acontece devido à fusão ou interpenetração de eixos incompletos dos elementos que compõem a ligação.
É fato que, se um elemento possui uma de suas orbitais incompletas (de apenas um elétron), ele pode fazer somente uma ligação covalente. Caso contrário, se ele tem dois de seus eixos incompletos, poderá realizar o processo no máximo duas vezes, e assim por diante.
Durante a hibridização sp3, um elétron do eixo “s” passa para o orbital “p” vazio, dando origem ao carbono intermediário (estado ativado). Logo em seguida, acontece a junção entre o eixo “s” e os três orbitais “p”, criando, dessa maneira, a hibridização do carbono sp3, diferentemente do sp2.
Hibridização do carbono: exercícios
Confira agora os melhores exercícios da matéria de hoje:
01. (ITA-SP) A(s) ligação(ões) carbono-hidrogênio existente(s) na molécula de metano (CH4) pode(m)
ser interpretada(s) como sendo formada(s) pela interação frontal dos orbitais atômicos “s” do átomo de hidrogênio, com os seguintes orbitais atômicos de carbono:
- a) Quatro orbitais p;
- b) Quatro orbitais sp3;
- c) Um orbital híbrido sp3;
- d) Um orbital “s” e três orbitais “p”;
- e) Um orbital “p” e três orbitais sp2.
02. (UERJ) Na composição de corretores do tipo “Liquid Paper”, além de hidrocarbonetos e dióxido de titânio, encontra-se a substância isocianato de alila, cuja fórmula estrutural plana é representada por CH2 = CH – CH2 – N = C = O. Com relação a esta molécula, é correto afirmar que o número de carbonos com hibridação sp2 é igual a:
- a) 1;
- b) 2;
- c) 3;
- d) 4.
03. (PUC-PR) A acetona (H3C-CO-CH3), um importante solvente orgânico, apresenta nos seus carbonos, respectivamente, os seguintes tipos de hibridação:
- a) sp, sp2 e sp3;
- b) sp3, sp3 e sp3;
- c) sp2, sp e sp3;
- d) sp3, sp2 e sp3;
- e) sp3, sp2 e sp2.
Resposta
Confira as respostas das questões acima para realizar a sua correção:
- 01) B;
- 02) B;
- 03) D.
O texto de hoje apresentou um conteúdo frequentemente cobrado nos vestibulares de todo Brasil. Esperamos que tenha aproveitado bastante e feito uma ótima leitura. Converse com seus amigos e professores e mostre que você é fera em hibridização do carbono!
Nunca deixe a matéria acumular a aproveite esse início de ano para pegar firme nos estudos. Com essas dicas, você terá o diferencial para passar no vestibular. Pode ter certeza, ainda sobra tempo para ver séries, praticar esportes e fazer o que mais gosta.
Quer continuar se preparando para as provas? Então leia agora esse ótimo texto sobre fotossíntese.
O Stoodi é seu grande aliado para mandar bem no Enem. Cadastre-se gratuitamente!