Amida: o que é, características e mais!
A Química Orgânica é caracterizada por estruturas que representam grupos que vão formar novas funções. No caso da amida, as ligações contribuem para a produção de vários produtos que são utilizados em grande escala pela sociedade. Entre eles, podemos citar explosivos, náilon, coletes à prova de bala, paraquedas, adubos, resinas, medicamentos, entre outros.
Como as ligações químicas sempre estão presentes nos principais vestibulares e no Enem, vamos explicar neste post tudo sobre a amida. Venha com a gente e aprenda mais!
O que é amida?
A amida ou amidas é explicada por uma cadeia de substâncias orgânicas que trazem em sua estrutura uma carbonila (C=O) juntamente com um nitrogênio.
Portanto, trata-se de produtos nitrogenados. O nitrogênio da amida pode conter um ou dois radicais ligados a ele.
As amidas contam com várias classificações, como primárias, secundárias ou monossubstituídas e terciárias, também conhecidas como dissubstituídas.
Podem ser polares, sólidas e, ainda, realizam ligações de hidrogênio. A amida tem ponto de ebulição elevado. Por isso, a maior parte é produzida em laboratório. Afinal, as amidas são mais densas que a água e solúveis em solventes orgânicos.
Resumidamente, as amidas trazem em sua estrutura um hidrogênio ligado a um grupo de carbonila (carbono com dupla ligação com o oxigênio).
Assim, podemos exemplificá-la com a seguinte fórmula:
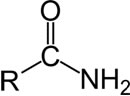
Nesse caso, “R” pode ser um hidrogênio ou qualquer grupo alquila ou arila. Com isso, para você entender claramente o assunto, saiba que a amida deriva de ácidos carboxílicos, substituindo a hidroxila (–OH) pelo grupo amino (–NH2).
As primárias têm como ligante o –NH2, enquanto as secundárias o –NHR. E as terciárias, o –NRR.
Para se chegar à amida, é preciso desidratar os sais de amônio (–NH4), hidratação de nitrilas (–CN) ou por meio das reações com sais oriundos do ácido.
Características das amidas
Assim como todos os produtos químicos, as amidas trazem na composição características específicas que revelam suas diferentes utilidades.
Entre elas, podemos citar o fato de serem menos densas do que a água, o aspecto básico e as moléculas polares. Além disso, existem forças intermoleculares que influenciam a manutenção das moléculas das amidas em uma forma coesa, também conhecida como dipolo permanente.
A amida é sólida com uma exceção: a metanamida, que é líquida. Ao contarem com poucos átomos de carbono, têm uma excelente solubilidade na água.
No entanto, a regra também vale para a situação ao contrário, ou seja, quanto mais carbono, menor a solubilidade em água. É nesse momento que solventes orgânicos podem ser utilizados para aumentar o processo de solução.
Os pontos de fusão e ebulição são grandes, principalmente em comparação a outras estruturas orgânicas.
Nomenclaturas das amidas
Na hora de realizar a nomenclatura da amida, você deverá inserir o nome do hidrocarboneto mais a terminação AMIDA, como você vê na figura abaixo:
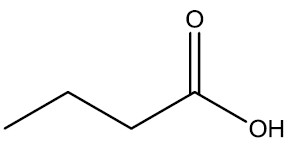 ⇒
⇒ 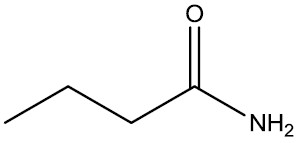 Ácido butírico/Butiramida
Ácido butírico/Butiramida
Se for cíclica, será conhecida como lactama, sendo reconhecida de acordo com o número de anéis. Quando há apenas ligações simples, une-se o prefixo (número de carbonos) com o infixo (tipos de ligações existentes entre os átomos de carbono da cadeia).
Exemplos:
- β-lactama para 4 átomos;
- γ-lactama para 5 átomos;
- δ-lactama para 6 átomos.
A amida pode ainda ser ramificada. Nessa situação, o nome e a posição de cada radical deverão ser escritos antes do prefixo, determinando a cadeia principal, ou seja, aquela que tiver o maior número de carbono.
Assim, uma ligação que tenha seis carbonos, por exemplo, terá o nome do radical mais o prefixo hex somado ao termo amida, como no desenho abaixo:
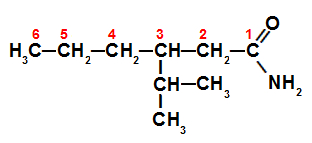
3-isopropil-hexanamida
Exemplos de amidas
Existem inúmeras fórmulas que descrevem amidas, como no caso dos medicamentos conhecidos como barbitúricos.
Eles são destinados como sedativos para ansiedade e alguns distúrbios psicológicos e psiquiátricos, como a epilepsia. Trata-se de um ácido representado pela seguinte fórmula: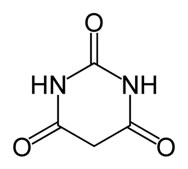
Outro exemplo muito comum na sociedade é a ureia, eliminada na urina e utilizada na produção de composto orgânico quando sintetizada em laboratório. Assim, pode ser aproveitada como matéria-prima na produção de fertilizantes, adubos, entre outros, como veremos logo mais.
A penicilina também se destaca, sendo lactamas na produção de antibióticos no combate a infecções. A função antibacteriana acontece em razão do anel β-lactâmico, de alta reatividade. Trata-se de uma descoberta do médico Alexander Fleming, em 1928.
Utilização das amidas
De acordo com cada reação, a amida pode gerar outras substâncias que são muito úteis na sociedade.
A ureia, por exemplo, está na matéria-prima do adubo, na alimentação do gado, no estabilizador de explosivos, em cremes hidratantes, resinas, medicamentos etc.
O náilon oriundo da amida é um composto fundamental na produção de paraquedas, tendas, macas, roupas íntimas, roupas esportivas e até para fios de sutura médica.
Uma curiosidade interessante é que o náilon foi utilizado pela primeira vez na elaboração de escovas de dente, mas o sucesso mesmo veio com a indústria têxtil, de shorts a meias.

Já o Kevlar, um material mais forte do que o aço e que também conta com a amida em sua composição, está presente em forros do compartimento do motor dos aviões, nos coletes e capacetes à prova de balas, nas roupas dos pilotos de Fórmula 1 e ainda em:
- raquetes de tênis;
- chassis de carros;
- cintos de segurança;
- bicicletas;
- roupas contra incêndios;
- esquis esportivos;
- cordas.
Uma informação interessante é que esse material só é derretido a uma temperatura de 350 graus celsius. Este é um dos motivos da presença em roupas fabricadas especialmente para quem corre o risco de ficar no meio das chamas, como bombeiros e competidores de esportes de velocidade.
Descubra a importância da amida no vestibular
Como você percebeu, a amida é extremamente importante quando o assunto é Química e sempre está presente nas provas dos principais vestibulares.
Por isso, a nossa dica é que você continue se aprofundando no assunto, além de praticar exercícios de provas anteriores. Dessa forma, seu desempenho será bem melhor, abrindo as portas para o sucesso profissional.
E você, quer arrasar no vestibular ? Então conheça o nosso plano de estudos e saia na frente da concorrência!