
Distribuição eletrônica: o que é, como fazer e mais!
Com certeza, você já se deparou com diversos exercícios de distribuição eletrônica nas aulas de Química, não é mesmo? Esse conteúdo, ainda que básico no universo químico, é fundamental para realizar todas as equações corretamente e garantir excelentes resultados no vestibular. Afinal, é por meio da distribuição que você consegue determinar a energia e o estado dos átomos em questão.
Mas, então, como é possível realizar a distribuição eletrônica da melhor forma a fim de conquistar excelentes notas no Enem e nas outras provas? Se você ainda não sabe como responder a essa questão, não se preocupe! Preparamos este artigo com as principais informações sobre esse processo para você mandar bem. Confira!
O que é distribuição eletrônica?
Antes mesmo de compreender como fazer distribuição eletrônica, precisamos entender o que ela é, concorda? Esse processo é caracterizado como a disposição dos elétrons de um átomo específico, ou seja, ela organiza os elétrons presentes no elemento para que ele permaneça no seu estado fundamental.
É justamente esse estado que permite que todos os elétrons fiquem em seus níveis mais baixos, garantindo que o átomo se mantenha em um estado mínimo de energia, também chamado de estado estacionário. Dessa maneira, a distribuição eletrônica apresenta a organização dos elétrons em relação a níveis ou camadas de energia que circulam ao redor do núcleo atômico.
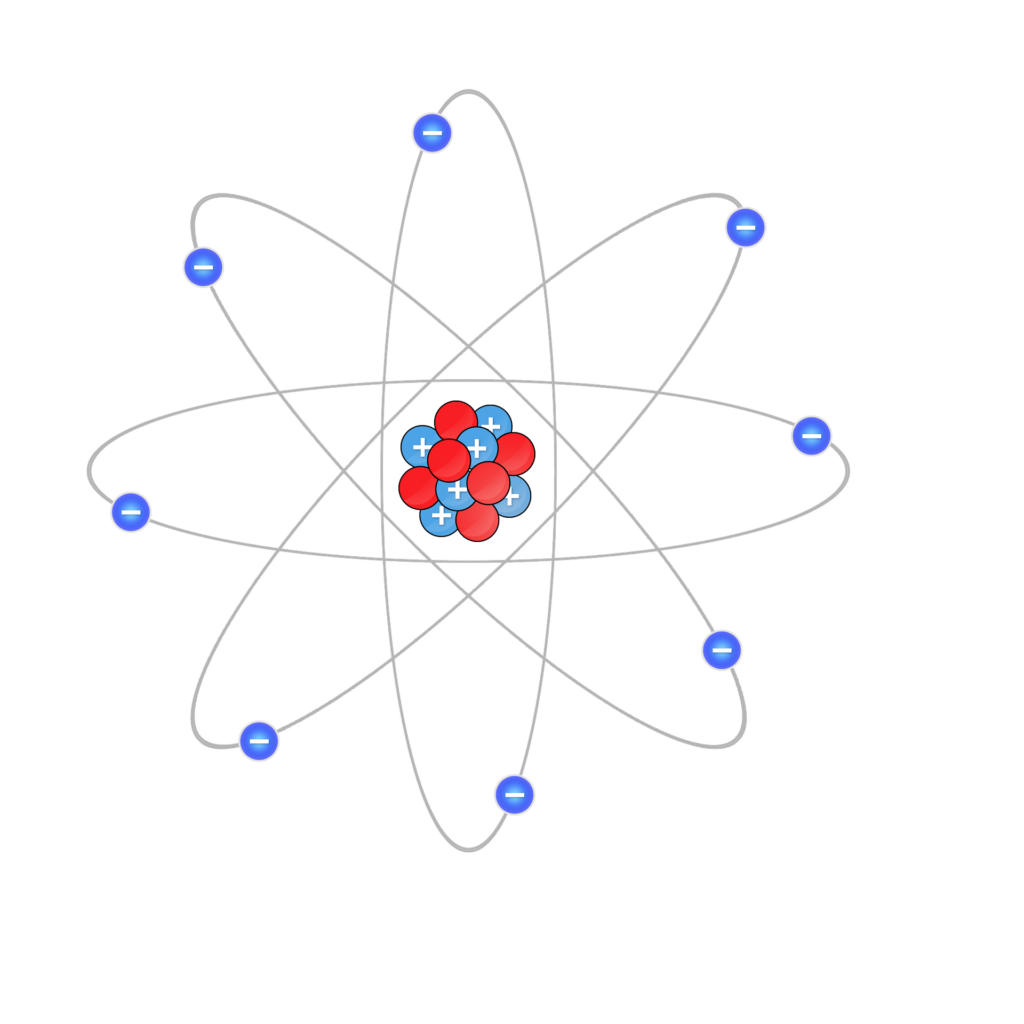
Então, quais são essas camadas de energia? Bom, a partir do modelo atômico de Rutherford-Böhr, podemos perceber que cada elemento apresenta um núcleo próprio com seus prótons e nêutrons, assim como uma eletrosfera formada por diversas camadas eletrônicas que, por sua vez, apresentam diferentes níveis de energia para cada tipo de átomo.
Dessa maneira, quando o elemento está no seu estado estacionário, ele apresenta diferentes níveis de energia de acordo com seu número quântico, variando de um a sete. Esses níveis, então, foram classificados por letras, reconhecidos como: K, L, M, N, O, P e Q.
Vale lembrar, ainda, que cada camada eletrônica apresenta um número máximo de elétrons que pode migrar entre os níveis. Assim, elas podem comportar, respectivamente: 2, 8, 18, 32, 32, 18 e 2 elétrons. Além disso, elas têm seus subníveis de energia para que os elétrons possam se movimentar na órbita: s, p, d, f.
Diagrama de Linus Pauling
Diante de todas essas informações, você deve estar se perguntando: “será que não existe uma forma mais fácil de compreender e realizar essa confusa distribuição?”. Bom, Linus Pauling, um grande cientista que investigou a Química e a Física quântica, também teve esse mesmo questionamento. Para facilitar o entendimento da ocupação dos elétrons nos orbitais dos átomos, ele desenvolveu um diagrama altamente funcional.
Conhecido como Diagrama de Linus Pauling, essa ferramenta auxilia até hoje os estudantes, físicos e químicos a compreenderem o funcionamento dos elétrons em cada átomo da Tabela Periódica. Como comentamos, cada camada apresenta seus subníveis em ordem crescente de energia, certo?
Assim, Pauling utilizou essa regra para formar uma visualização da ordem dos elétrons nas camadas de energia, determinando como ocorre a distribuição eletrônica. Confira:
- K: 1s2;
- L: 2s2 2p6;
- M: 3s2, 3p6, 3d10;
- N: 4s2, 4p6, 4d10, 4f14;
- O: 5s2, 5p6, 5d10, 5f14;
- P: 6s2, 6p6, 6d10;
- Q: 7s2, 7p6.
É importante ter em mente, ainda, que o nível da camada é representado pelo seu número (de um a sete), enquanto a letra representa o subnível e o número sobrescrito, a quantidade de elétrons que o subnível comporta na distribuição.
Como fazer distribuição eletrônica?
Com o conceito em mente, está na hora de colocar a mão na massa e realizar a distribuição eletrônica. Afinal, essas são as perguntas que podem aparecer nos grandes vestibulares para colocar o seu conhecimento em prática. Para ajudar nessa missão, realizaremos como exemplo a distribuição eletrônica do Magnésio (Mg). Acompanhe:
Ao olhar na Tabela Periódica, podemos identificar que o número atômico do Mg é 12, considerando que o estado fundamental apresenta as condições necessárias para que a quantidade de elétrons e de prótons seja igual, sabemos que o Mg apresenta 12 elétrons, certo?
Com esse valor em mente, começamos nossa distribuição pelo subnível 1s. Como você já deve ter percebido, o primeiro subnível só comporta dois elétrons. Então, precisamos seguir em frente e passar para a próxima camada (2s). Ao manter essa linha de raciocínio, vemos que a distribuição ficou da seguinte forma:
- K: 1s2;
- L: 2s2 2p6;
- M: 3s2, 3p, 3d;
- N: 4s, 4p, 4d, 4f;
- O: 5s, 5p, 5d, 5f;
- P: 6s, 6p, 6d;
- Q: 7s, 7p.
Isso acontece porque o átomo de Magnésio não apresenta mais elétrons para preencher todas as camadas, tendo a M como seu último nível. Por meio dele, podemos ver que o elemento em questão apresenta dois elétrons na camada K, oito elétrons na camada L e dois elétrons da camada M, não é verdade?
No entanto, se você quiser fazer a distribuição eletrônica pelas camadas do átomo, é fundamental ter em mente que a última camada, também conhecida como camada de valência, não pode apresentar mais do que oito elétrons, ainda que a quantidade máxima seja 18, por exemplo.
Nesse sentido, para elementos como o Cálcio, que apresenta número atômico igual a 20, você precisa ficar de olho e conferir se a última camada apresenta mais do que 8 elétrons, combinado? Caso apresente, é necessário distribuir para mais uma camada.
Distribuição eletrônica: exercícios
Você sabia que uma das melhores formas de potencializar a sua aprendizagem é por meio de exercícios? Capazes de colocar em prática aquilo que foi aprendido, eles estimulam o conhecimento e auxiliam na assimilação do conteúdo. Por isso, separamos a seguir dois exercícios para você treinar o que acabou de ler sobre a distribuição eletrônica. Acompanhe:
1. (PUC Minas 2015 – adaptado). Um elemento químico cuja distribuição eletrônica é 1s2 2s2 2p6 3s2 3p1 está presente em diversos utensílios domésticos. Sobre esse elemento químico, são feitas as afirmações a seguir.
I. Encontra-se no terceiro período da tabela periódica;
II. É classificado como ametal;
III. Tem tendência a formar ligações iônicas com metais;
IV. Possui 3 elétrons na camada de valência.
São CORRETAS as afirmações:
a) I e IV.
b) I e II.
c) II e III.
d) III e IV.
2. (IFSP – adaptado). Na classificação periódica, o período e grupo ou família em que o elemento químico de configuração eletrônica 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4 está localizado são, respectivamente:
a) 3 e 13 ou 3A.
b) 4 e 14 ou 4A.
c) 6 e 14 ou 4A.
d) 4 e 16 ou 6A.
e) 6 e 16 ou 6A.
Estudar sobre a distribuição eletrônica é um passo muito importante para garantir excelentes resultados no vestibular. Afinal, é conhecendo como os átomos estão organizados em termos de energia e distribuição dos elétrons que você consegue identificar seus níveis e subníveis a fim de conhecer as tendências de ligação e classificá-los corretamente.
E então, o que achou do nosso artigo? Para conquistar resultados ainda melhores no vestibular, conheça o nosso plano de estudos e monte um planejamento eficiente para suas provas!
Respostas corretas:
1 – A
2 – D