
Gás ideal: o que é, leis e exercícios!
Todos sabemos o que são sólidos, líquidos e gases, mas, e gases ideais, você já ouviu falar? Esse conceito é muito importante para os estudos de Físico-química, então continue lendo para saber tudo.
O que é gás ideal?
Os gases diferem-se de líquidos e sólidos por terem a capacidade de, quando colocados em um recipiente, ocupá-lo por completo. Para facilitar o estudo dos gases, idealizou-se um modelo para os gases reais — os chamados gases ideais, os quais seguem exatamente a teoria cinética dos gases.
Leis dos gases ideais
As leis dos gases ideais foram criadas por físico-químicos entre os séculos XVII e XIX e relacionam os gases à temperatura, volume e pressão. São conhecidas como:
- Lei de Boyle;
- Lei de Gay-Lussac;
- Lei de Charles.
Vale lembrar da Equação de Clapeyron, que relaciona essas três leis. Veja cada uma a seguir.
Lei de Boyle
Desenvolvida pelo físico-químico Robert Boyle, apresenta a transformação isotérmica sofrida pelo gás. Nela, a temperatura permanece constante e a pressão e o volume do gás são inversamente proporcionais. É expressa pela seguinte equação:
P . V = K
em que, P é a pressão, V o volume e K a constante de temperatura.
Ley de Gay-Lussac
Desenvolvida pelo físico-químico Robert Boyle, apresenta a transformação isotérmica sofrida pelo gás. Nela, a temperatura permanece constante e a pressão e o volume do gás são inversamente proporcionais. É expressa pela seguinte equação:
V = K . T
em que, P é a pressão, V o volume e K a constante de temperatura.
Lei de Charles
Essa lei foi desenvolvida pelo francês Jacques Alexandre Cesar Charles. Apresenta a transformação isovolumétrica, isométrica ou isocórica dos gases ideais. Nesse tipo de transformação, o volume permanece constante enquanto a pressão e a temperatura são diretamente proporcionais. É representada pela equação abaixo:
P = K . T
em que P é a pressão, T a temperatura e K a constante de volume.
Gás ideal: exercícios
1. Considere que em um recipiente com êmbolo móvel, capaz de deslizar sem atrito, contém 20 litros de O2(g) sob pressão de 160 kPa a 298 K. Que volume o gás passará a ocupar se a pressão for reduzida para 80 kPa nessa mesma temperatura?
Resolução:
Como se trata de uma transformação isotérmica, usamos a Lei de Boyle, que pode ser reescrita como:
P . V = P2 . V2
160 . 20 = 80 . V2
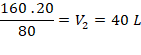
Esperamos que você tenha aprendido mais sobre os gases ideais. Para fazer mais exercícios, visite o nosso site! Também temos videoaulas com todos os conteúdos mais importantes de Química e de outras disciplinas para você mandar bem no Enem!